Sobat pembaca tentu tidak asing lagi dengan teori atom bukan? Jika sobat pernah menginjak bangku sekolah, tentu pernah mendapatkannya dalam pelajaran kimia. Secara khusus pada artikel kali ini, kita akan membahas tentang atom secara lengkap dari awal dan perkembangannya.
Kata atom sendiri berasal dari bahasa Yunani yaitu atomos (a = tidak, tomos = terbagi). Atom digambarkan sebagai partikel-partikel kecil yang berdiri sendiri dan mampu bersenyawa dengan partikel lain.
Dua ahli filsafat Yunani yang pertama kali mengemukakan teori atom adalah Leucippus dan Democritus. Teori tersebut dicetuskan sekitar 450 tahun sebelum masehi. Keduanya menyebutkan bahwa semua materi bisa dibagi menjadi partikel-partikel kecil hingga tidak bisa terbagi lagi. Nah, partikel terkecil dan tidak bisa terbagi lagi itulah yang disebut dengan atom.
Hanya saja, partikel terkecil yang disebut atom tersebut hanya berupa teori. Sebab, sampai saat ini belum ada yang mampu melihatnya, baik secara langsung maupun menggunakan alat bantu semisal mikroskop.
Perkembangan Teori Atom
Sejak awal kemunculannya, teori atom terus mengalami perkembangan dalam rangka menyempurnakan yang sebelumnya. Klimaksnya pada tahun 1800, ketika munculnya beberapa penemuan baru yang berkaitan dengan teori tersebut.
Berikut ini beberapa perkembangan teori atom berdasarkan penjelasan tokoh-tokoh yang mengemukakannya :
Dalton (John Dalton)
Pencetus perkembangan teori atom yang pertama kali oleh seorang tokoh yang bernama John Dalton. Dalam perkembangan yang dikemukakannya pada tahun 1803, disebutkan kalau teori atom dibangun di atas dua hukum, yaitu hukum Lavoisier (hukum kekekalan massa) dan hukum Proust (hukum susunan tetap).
Isi Teori Atom John Dalton
- Atom merupakan bagian paling kecil dari sebuah unsur. Oleh karena itu tidak dapat terbagi lagi.
- Atom-atom sejenis mempunyai kesamaan dalam sifat, sedangkan atom-atom tidak sejenis memiliki perbedaan sifat.
- Penggabungan atau pemisahan atom terjadi dalam reaksi kimia.
- Atom bisa bergabung dengan atom lainnya dalam proses pembentukan molekul dengan perbandingan bulat dan sederhana.
Sayangnya teori di atas memiliki beberapa kekurangan, di antaranya :
- Tidak ada penggambaran yang jelas bagaimana cara atom saling bergabung.
- Masing-masing dari setiap unsur atom tidak bisa dideskripsikan.
- Tidak mampu mendeskripsikan sifat listrik materi dengan jelas.
- Tidak mampu mendeskripsikan hubungan senyawa yang terdapat pada larutan senyawa dengan daya hantar arus listrik.
Thomson (Sir Joseph John Thomson)
Setelah munculnya teori atom Dalton yang memiliki beberapa kekurangan, muncullah teori atom berikutnya yang dikemukakan oleh tokoh Sir Joseph John Thomson pada tahun 1897. Kemunculan teori model atom Thomson ini memperbaiki kekurangan-kekurangan yang sebelumnya terdapat pada teori atom Dalton.
Isi Teori Atom Thomson
- Atom bukanlah bagian paling kecil dari suatu zat.
- Massa elektron atom memiliki ukuran yang lebih kecil dari massa atom.
- Secara keseluruhan atom bersifat netral. Pasalnya, muatan atom positif dan negatif pada atom sama. Selain itu, atom tidak memiliki muatan positif dan negatif yang sifatnya berlebihan.
- Atom bermuatan positif tersebar secara merata ke seluruh bagian atom. Nantinya atom tersebut dinetralkan oleh elektron-elektron yang tersebar di antara muatan positifnya.
Sebagaimana sebelumnya, teori di atas juga memiliki beberapa kekurangan, yaitu :
- Tidak mampu menjelaskan detail susunan muatan positif dan jumlah elektron yang terdapat di dalam bola.
- Inti atom tidak bisa dijelaskan dengan gamblang.
Rutherford (Ernest Rutherford)
Perkembangan teori atom terus berlanjut dengan munculnya teori baru yang dikemukakan oleh Ernest Rutherford. Tokoh yang lahir di Selandia Baru dan berkebangsaan Inggris ini merupakan murid sekaligus partner dari Thomson. Teori yang dikemukakannya merupakan pengembangan dan perbaikan dari teori milik gurunya yaitu Thomson.
Isi Teori Atom Rutherford
- Atom berupa inti atom bermuatan positif yang dikelilingi oleh elektron-elektron bermuatan negatif. Jadi, bentuknya menyerupai model tata surya.
- Atom bersifat netral dikarenakan muatan positif yang terkandung di dalamnya seimbang dengan muatan negatif.
- Selama mengitari inti, gaya sentripetal yang terdapat pada elektron dibentuk oleh gaya tarik menarik yang terjadi di antara elektron dengan gaya inti atom (gaya Coulomb).
- Sebagian besar volume atom berupa ruang kosong (bukan pejal). Sebabnya adalah ukuran jari-jari inti atom lebih kecil dibandingkan jari-jari atom.
Sebagaimana sebelumnya, teori di atas juga memiliki beberapa kekurangan. Berikut ini 3 kekurangan yang ada pada teori tersebut :
- Tidak mampu memberikan deskripsi mengenai cara rotasi dari inti atom dan letak dari elektron.
- Tidak mampu memberikan deskripsi spektrum garis yang terdapat pada atom hidrogen.
- Energi atom tidak stabil akibat pancaran energi dari elektron yang bergerak.
Baca Juga : Aplikasi Microsoft Math Solver Bikin Kamu Pinter Matematika
Bohr (Niels Bohr)
Setelah tersebarnya teori Rutherford, para ilmuwan menyepakati kalau sebuah atom terdiri dari elektron dan inti atom. Hanya saja, teori ini dianggap belum mampu memberikan penjelasan struktur suatu atom. Ini merupakan kelemahan dari teori atom tersebut.
Berangkat dari kekurangan ini, muncullah seorang fisikawan yang bernama Niels Bohr. Fisikawan asal Denmark ini melakukan penelitian pada tahun 1913 dan berhasil memunculkan teori atom baru yang disebut Teori Atom Bohr.
Isi Teori Atom Bohr
- Atom dikelilingi oleh elektron pada orbit tertentu.
- Selama mengelilingi atom dalam lintasan, energi elektron bersifat tetap. Oleh karena itu, tidak ada energi yang diserap atau dipancarkan.
- Elektron hanya mampu berpindah dari satu kulit ke kulit lainnya. Cara perpindahannya adalah dengan menyerap atau memancarkan energi.
- Lintasan-lintasan yang diperbolehkan elektron hanyalah lintasan-lintasan yang mempunyai momentum sudut kelipatan bulat dari h2π (π=3,14).
Sebagaimana sebelumnya, teori yang satu ini juga memiliki beberapa kekurangan, yaitu :
- Tidak mampu menerangkan spektrum atom yang lebih besar daripada hidrogen.
- Tidak mampu memberikan penjelasan mengenai efek Zeeman.
Mekanika Kuantum
Setelah kehadiran teori atom Bohr, muncullah teori mekanika kuantum untuk menyempurnakan kekurangan yang terdapat pada teori sebelumnya. Teori tersebut dikemukakan oleh fisikawan dari Austria yang Erwin Schrödinger. Fisikawan ini merupakan peraih Nobel Fisika pada tahun 1933.
Selain Schrödinger, teori atom mekanika kuantum juga dikemukakan oleh Werner Heisenberg. Kedua peneliti ini (Erwin Schrödinger dan Werner Heisenberg) mengembangkan teori modern yang bernama mekanika kuantum.
Akhir Kata
Demikianlah ulasan mengenai teori atom dan perkembangannya yang bisa saya sebutkan pada postingan kali ini. Semoga sobat pembaca bisa memahami apa yang telah dijelaskan, dan bisa menjadi tambahan pengetahuan bagi sobat sekalian.
Untuk melengkapi pembahasan di atas, sobat bisa merujuk pada buku-buku pelajaran kimia yang membahas tentang masalah tersebut. Hanya saja, saya berharap penjelasan singkat dan sederhana di atas bisa menutupi rasa ingin tahu sobat terkait masalah ini.
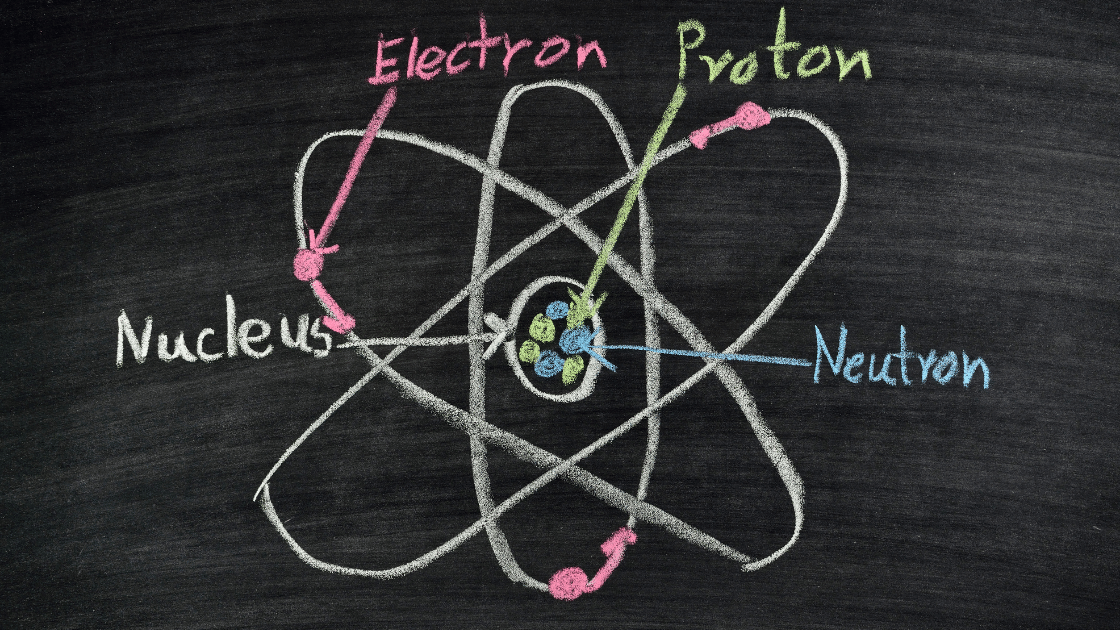
Menurut Wikipedia, Atom adalah suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri atas proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak memiliki neutron).
Teori Atom ada berbagai macam diantaranya adalah Dalton, Thomson, Rutherford, dan Bohr.
Menurut Dalton, atom adalah bagian terkecil yang tidak dapat dibagi-bagi lagi. Menurut Thomson, atom adalah bola pejal positif yang di dalamnya tersebar muatan-muatan negatif. Sedangkan Menurut Rutherford, atom terdiri dari inti atom yang bermuatan positif dan dikelilingi oleh muatan negatif pada kulit atom.









Leave a Comment